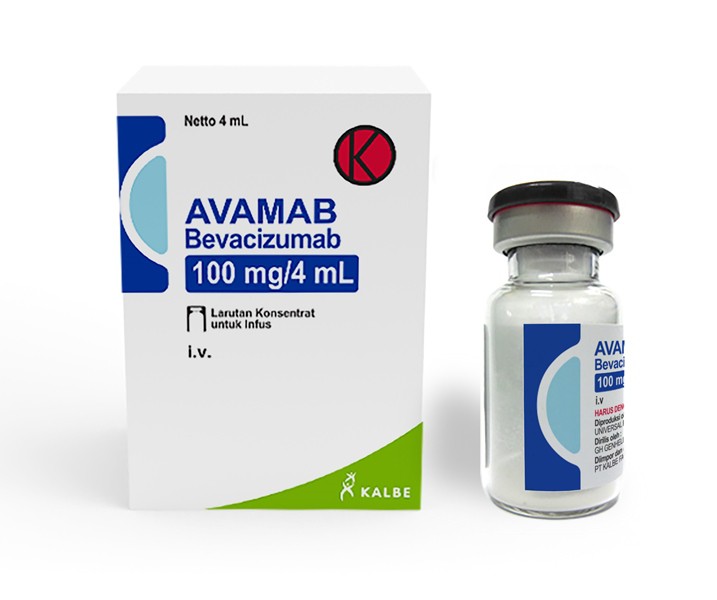
Baru-baru ini US FDA menyetujui produk bevacizumab-maly sebagai produk biosimilar bevacizumab. Persetujuan produk ini adalah berdasarkan data yang menunjukkan bahwa produk tersebut sangat menyerupai produk referensi dan tidak terdapat perbedaan yang bermakna secara klinis antara keduanya. Di Indonesia, produk ini juga telah mendapat nomor izin edar dari BPOM.
Produk bevacizumab-maly merupakan penghambat VEGF yang diindikasikan untuk terapi pasien dengan kondisi berikut:
- Kanker kolorektal metastatik, kombinasi dengan kemoterapi berbasis fluorouracil sebagai terapi lini pertama atau kedua.
- Kanker kolorektal metastatik, kombinasi dengan kemoterapi berbasis fluoropyrimidine-irinotecan atau fluoropyrimidine-oxaliplatin sebagai terapi lini kedua pada pasien yang progresif dengan regimen lini pertama mengandung bevacizumab.
- Non-small cell lung cancer (NSCLC) non-skuamosa yang tidak dapat direseksi, lokal lanjut, rekuren, atau metastatik, kombinasi dengan carboplatin dan paclitaxel sebagai terapi lini pertama.
- Glioblastoma rekuren pada dewasa.
- Karsinoma sel renal metastatik, kombinasi dengan interferon-alfa.
- Kanker serviks persisten, rekuren, atau metastatik, kombinasi dengan paclitaxel dan cisplatin atau paclitaxel dan topotecan.
- Kanker ovarium epitelial, tuba falopi, atau peritoneum primer, kombinasi dengan paclitaxel, pegylated liposomal doxorubicin, atau topotecan untuk penyakit rekuren resisten platinum yang telah mendapat tidak lebih dari 2 regimen kemoterapi sebelumnya.
Produk bevacizumab-maly tidak diindikasikan untuk terapi adjuvan kanker kolon. Kurangnya efikasi bevacizumab sebagai tambahan pada kemoterapi standar untuk terapi adjuvan kanker kolon ditentukan dalam 2 studi klinik multisenter, label terbuka, secara acak. Produk ini tersedia dalam vial mengandung 100 mg/4 mL dan 400 mg/16 mL bevacizumab-maly.
Selain disetujui di US FDA, produk ini sudah terlebih dahulu disetujui oleh komisi Eropa pada 31 Maret 2021 setelah dikeluarkannya rekomendasi positif dari EMA (European Medicine Agency) pada 25-29 Januari 2021. Di Eropa, produk ini diindikasikan untuk kanker kolorektal, kanker paru, kanker payudara, karsinoma sel renal, kanker ovarium epitelial, tuba falopi, atau peritoneum primer, dan kanker serviks.
Sama halnya dengan US FDA, produk ini sangat menyerupai produk referensi dan data menunjukkan kualitas, keamanan, dan efikasi yang sebanding dengan produk referensi.
Informasi keamanan yang penting dari produk ini mencakup peringatan dan perhatian perdarahan berat dan fatal, kejadian tromboemboli arteri dan vena, hipertensi, krisis hipertensi, dan ensefalopati hipertensi, cedera ginjal, proteinuria dan sindrom nefrotik, sindrom ensefalopati posterior reversibel, toksisitas embrio-janin, kegagalan ovarium, gagal jantung kongestif, perforasi saluran cerna dan fistula, pembedahan dan komplikasi penyembuhan luka, dan reaksi terkait infus. Efek samping yang dilaporkan adalah epistaksis, perdarahan, hipertensi, dermatitis eksfoliatif, proteinuria, nyeri punggung, sakit kepala, rinitis, perubahan pengecapan, kulit kering, dan gangguan lakrimasi.
Simpulan:
Biosimilar bevacizumab telah dietujui oleh US FDA dan Komisi Eropa serta BPOM. Dasar dari persetujuan tersebut adalah produk ini sangat menyerupai produk referensi dan data menunjukkan kualitas, efikasi, dan keamanan yang sebanding dengan produk referensinya.
Gambar: Ilustrasi (Freepik)
Referensi:
1. FDA approves alymsys. Drugs.com [Internet]. 2021 April 13 [cited 2021 April 18]. Available from: https://www.drugs.com/newdrugs/fda-approves-alymsys-bevacizumab-maly-biosimilar-avastin-5819.html
2.. Park B. Bevacizumab biosimilar alymsys gets FDA approval. Cancer Therapy Advisor [Internet]. 2021 April 15 [cited 2021 April 18]. Available from: https://www.cancertherapyadvisor.com/home/cancer-topics/gastrointestinal-cancers/bevacizumab-biosimilar-alymsys-gets-fda-approval/
3. Biosimilar News. EC approval for bevacizumab biosimilar alymsys/oyavas. GaBi [Internet]. 2021 April 23 [cited 2022 April 18]. Available from: https://www.gabionline.net/biosimilars/news/EC-approval-for-bevacizumab-biosimilar-Alymsys-Oyavas