Leukemia mieloid kronik Philadelphia positif (chronic myeloid leukemia/CML Ph+) dapat mengakibatkan resistensi terhadap obat atau efek samping yang tidak dapat diterima. Penghambat tyrosine kinase (TKI) yang telah disetujui terutama memiliki target ATP-binding site BCR-ABL1, dan sekitar separuh dari resistensi klinis dikaitkan dengan mutasi yang didapat, sehingga ada perubahan konformasional yang menyebabkan TKI tidak aktif.
Mutasi T315I dilaporkan pada sekitar 25% pasien, hal ini menjadi concern karena resisten dengan tyrosine kinase inhibitor (TKI) yang tersedia kecuali ponatinib. Efek samping yang tidak dapat diterima dijumpai pada sekitar 25% pasien, dengan TKI generasi kedua dan ketiga memiliki risiko efek toksik vaskuler dan paru.
Baru-baru ini, asciminib telah disetujui oleh US FDA untuk terapi pasien dewasa dengan CML Ph+ fase kronik yang sebelumnya diterapi dengan 2 atau lebih TKI. Selain itu, obat ini juga disetujui untuk terapi pasien dewasa dengan CML Ph+ fase kronik dengan mutasi T315I. Asciminib adalah penghambat BCR-ABL1 yang poten dan spesifik yang berbeda dari penghambat ABL1 kinase yang telah disetujui karena tidak mengikat ATP-binding site kinase.
Sebaliknya, asciminib berperan sebagai penghambat alosterik dan mengikat kantung domain kinase yang normalnya diduduki oleh myristoylated N-terminal ABL1, sehingga keadaan menjadi tidak aktif. Pada keadaan fusi ABL1 ke BCR, myristoylated N-terminal hilang dan ABL1 kinase menjadi aktif. Asciminib mengikat myristoyl site dan mengembalikan penghambatan aktivitas BCR-ABL1 kinase. Asciminib sangat selektif terhadap ABL1 kinase dan secara hipotesis, ABL2 kinase, dengan aktivitas rendah terhadap BCR-ABL1 tidak mutasi dan selektif terhadap ATP-site mutants termasuk T315I.
Persetujuan asciminib ini adalah berdasarkan data studi fase III ASCEMBL yang dilakukan pada pasien CML Ph+ fase kronik yang diterapi dengan 2 atau lebih TKI. Pasien secara acak mendapat asciminib 40 mg oral, 2 kali sehari atau bosutinib 500 mg, 1 kali sehari sampai toksisitas tidak dapat diterapi atau terjadi kegagalan terapi.
Dalam studi tersebut, didapatkan hasil berikut: (n= 233)
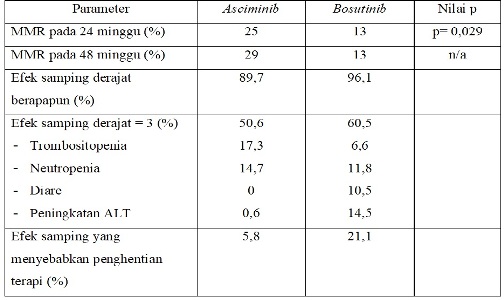
Sementara itu, dasar persetujuan asciminib untuk pasien CML Ph+ fase kronik dengan mutasi T315I adalah hasil uji klinik pada 45 pasien. Pasien mendapat asciminib 200 mg, 2 kali sehari sampai toksisitas tidak dapat ditoleransi atau terjadi kegagalan terapi. MMR dicapai pada 24 minggu sebesar 42%, sedangkan pada 96 minggu sebesar 49%. Median durasi terapi adalah 108 minggu.
Efek samping yang sering dilaporkan pada asciminib (≥ 20%) adalah infeksi saluran napas atas, nyeri muskuloskeletal, fatigue, mual, ruam, dan diare. Abnormalitas laboratorium yang sering dijumpai adalah penurunan jumlah trombosit, peningkatan trigliserida, penurunan jumlah neutrofil, penurunan hemoglobin, peningkatan creatine kinase, peningkatan ALT, peningkatan lipase, dan peningkatan amilase.
Simpulan:
Asciminib telah disetujui oleh US FDA untuk terapi pasien dewasa dengan CML Ph+ fase kronik yang sebelumnya diterapi dengan 2 atau lebih TKI dan terapi pasien dewasa dengan CML Ph+ fase kronik dengan mutasi T315I.
Gambar: Ilustrasi
Referensi:
1. FDA approves asciminib for Philadelphia chromosome-positive chronic myeloid leukemia. FDA [Internet]. 2021 Oct 29 [cited 2021 Nov 9]. Available from: https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-asciminib-philadelphia-chromosome-positive-chronic-myeloid-leukemia
2. Karlovitch S, Tucker N. FDA approves asciminib for adults with Ph+ CML-CP. Targeted Oncology [Internet]. 2021 Oct 30 [cited 2021 Nov 9]. Available from: https://www.targetedonc.com/view/fda-approves-asciminib-for-adults-with-ph-cml-cp
3. Hughes TP, Mauro MJ, Cortes JE, Minami H, Rea D, DeAngelo DJ, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med. 2019;381:2315-26.